
כך נוצר כא"מ
בכדי שיזרום זרם קבוע במעגל עם התנגדות צריך מקור כא”מ. זרם העובר במעגל גורם לפליטה של אנרגיה – למשל אנרגיית חום בנגדים. ברור כי האנרגיה הזאת לא נוצרת יש מאין – אותה מספק מקור הכא”מ כתוצאה מתהליכים כאלה ואחרים שמתרחשים בו.
מקור הכא”מ הראשון שאפשר שימוש נרחב בזרם חשמלי היה אלמנט גלווני (או תא גלווני). בתוך אלמנט גלווני מתרחשים תהליכים כימיים בהם משתחררת אנרגיה שלאחר מכן מסופקת למעגל. מקור כימי כזה נבנה לראשונה על ידי הפיזיקאי אלסנדרו וולטה (1745-1827). וולטה גילה שכאשר מביאים מוליכים שונים במגע, בנקודות המגע מתרחשת הפרדת מטענים (כלומר נוצר כא”מ) – על מוליך אחד נוצר עודף אלקטרונים, ועל האחר – מחסור באלקטרונים (למעשה, גלווני היה הראשון שגילה את התופעה, אך הוא לא הסביר אותה נכון). אולם כפי שבירר וולטה, במעגל חשמלי סגור שמתקבל מחיבור של מוליכים מסוג ראשון בלבד (מוליכים בהם לא מתרחשים שינויים כימיים כאשר עובר דרכם זרם חשמלי – כמו מתכת או פחם) לא יווצר כא”מ. ניתן להיווכח בכך בניסוי הבא.
ניקח תיל מברזל ונחבר לכל קצה תילי נחושת. את הקצוות החופשיים של תילי הנחושת נחבר אל מד זרם. במצב כזה מתקבל מעגל חשמלי סגור המורכב ממוליכים מסוג ראשון (מתכות – ברזל ונחושת). אפילו מד הזרם הרגיש ביותר לא יורה על זרם במעגל. גם אם במקום תיל מברזל ניקח תיל מאבץ, וגם אם נחבר את המוליכים באופנים שונים – עדיין לא יהיה זרם במעגל.
אם כן, הכא”מ במעגל חשמלי שמורכב ממספר אקראי של מתכות שונות שווה לאפס (חוק וולטה). קיים קשר עמוק בין חוק וולטה לבין העובדה שבמתכות (מוליכים מסוג ראשון) דרכן עובר זרם חשמלי לא חלים שינויים כימיים. אילו חוק וולטה לא היה מתקיים, היינו יכולים ליצור מעגל שבו הזרם היה זורם במשך הרבה מאוד זמן והיה יכול לבצע עבודה, למשל, לסובב מנוע, מבלי שהאנרגיה האגורה במעגל תקטן. ואכן, האנרגיה הפנימית של מעגל כזה לא יכולה לקטון שכן החומרים שמהם הוא מורכב (מתכות), לא משתנים מבחינה כימית. אבל אם האנרגיה הפנימית לא יכולה לקטון ואם לא נוסף למעגל חום מבחוץ, אזי לפי חוק שימור האנרגיה לא יכולה להתבצע שום עבודה, כלומר במעגל לא יכול לזרום זרם במשך זמן רב.
האם זה לא עומד בסתירה למה שגילה וולטה לגבי חיבור מוליכים שונים? הרי אם בנקודות המגע נוצר כא”מ, כיצד ייתכן שהכא”מ הזה לא גורם לזרם במעגל? ובכן, אין כאן שום סתירה. במעגל המורכב ממוליכים שונים מסוג ראשון בלבד, יש לפחות שתי נקודות חיבור (מקומות בהם מוליכים שונים באים במגע). לפיכך, במעגל נוצרים מספר כא”מים שונים הנבדלים בסימן שלהם, והכא”מ השקול שווה לסכום האלגברי של כל הכא”מים האלה. הסכום האלגברי הזה שווה לאפס – למרות שהכא”מים הנפרדים שונים מאפס, ולכן לא נוצר זרם במעגל.
אולם המצב יהיה שונה אם נכניס לפחות מוליך אחד מסוג שני לתוך המעגל. מוליכים מסוג שני כן מושפעים מהזרם – ההרכב הכימי שלהם משתנה. השינוי הזה יכול לחולל תהליכים כימיים שונים שכתוצאה מהם, האנרגיה הפנימית (הכימית) של המוליך תקטן, ועל חשבונה יוכל לזרום זרם חשמלי. ואכן, וולטה יצר את האלמנט הגלווני הראשון על ידי כך שטבל לוחיות נחושת ואבץ בתוך תמיסה של חומצה גופרתית – כיום אלמנט זה ידוע בשם אלמנט וולטה. אם נחבר מוליך ללוחית הללו נקבל זרם חשמלי.
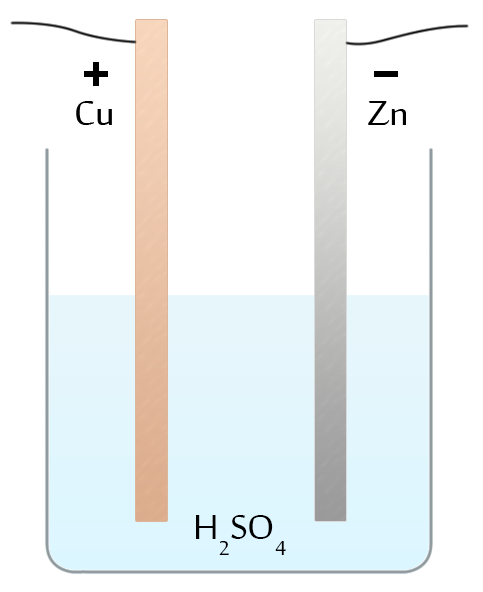
איור 1 – תא וולטה – שתי מתכות שונות (נחושת ואבץ) שקועות בתוך אלקטרוליט (חומצה גופרתית)
אלמנט וולטה כולל את כל הרכיבים הנחוצים לאלמנט גלווני: שני מוליכים מסוג ראשון (אבץ ונחושת) שבאים במגע עם מוליך מסוג שני (תמיסה של חומצה גופרתית). כבר עכשיו צריך לציין שמעשית, לא נוח להשתמש באלמנט וולטה מהסיבה שהכא”מ שלו “נגמר” מהר מאוד. בפועל, משתמשים בשילובים יותר “מוצלחים” של מוליכים מסוג ראשון ומסוג שני.
לוחיות של כל אלמנט גלווני שביניהן נוצר הפרש פוטנציאלים, נקראות הדקים (או אלקטרודות). אלקטרודה בעלת הפוטנציאל הגבוה יותר נקראת אלקטרודה חיובית (או אנודה), והאלקטרודה בעלת הפוטנציאל הנמוך – אלקטרודה שלילית (או קתודה). באלמנט וולטה – נחושת היא האלקטרודה החיובית. למוליך מסוג שני שאיתו באות במגע האלקטרודות (בדרך כלל, זה חומצה) קוראים אלקטרוליט.
תא דניאל
כפי שאמרנו, קיימים אלמנטי גלווני מוצלחים יותר מתא וולטה. אולי המוכר והפשוט ביותר הוא תא דניאל. מדובר בתא גלווני שהאלקטרודה החיובית שלו, שעשויה מנחושת, שקועה בתוך נחושת גופרתית, והאלקטרודה השלילית, העשויה מאבץ, שקועה בתוך אבץ גופרתי (או בתוך חומצה גופרתית). במבנה הסטנדרטי של תא דניאל (איור 2), האלקטרודות נמצאות בתוך כלי (1) – אלקטרודת אבץ (4) שקועה בתוך תמיסה של $\mathrm{ZnSO_4}$ ואלקטרודת הנחושת (2) שקועה בתוך תמיסה של $\mathrm{CuSO_4}$. בכדי למנוע התערבבות מהירה של התמיסות, מפרידים אותן באמצעות מחיצה נקבובית (3) העשויה מחרס.
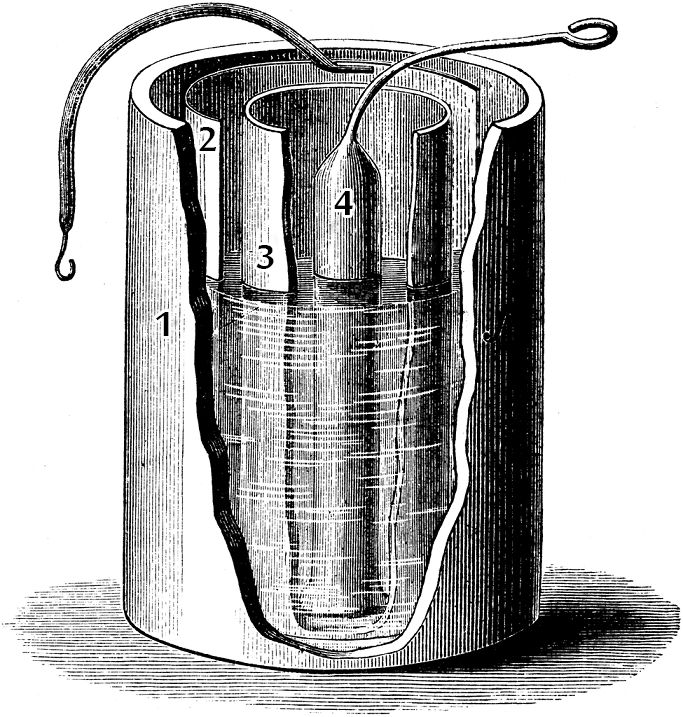
איור 2 – תא דניאל במבנה הסטנדרטי שלו (מקור).
הכא”מ של תא דניאל, להבדיל מהכא”מ של תא וולטה, נשמר קבוע במשך זמן רב יותר. (הכא”מ של תא דניאל רגיל שווה בערך ל-$1.09 \mathrm{V}$).
כמובן שקיימים הרבה סוגים שונים של אלמנטים גלווניים – יש כאלה שיוצרים מתח קבוע ויש כאלה שהמתח שהם מספקים יכול להשתנות בצורה ניכרת עם הזמן כתוצאה מתהליכים כימיים משניים. אנו לא נדון בסוגים השונים שיש, אך נציין כי הכא”מ של כל אלמנט גלווני נקבע אך ורק על ידי החומרים שמהם הוא מורכב, כלומר על ידי סוג האלקטרוליט וסוג המתכת שממנו עשויות האלקטרודות. הכא”מ לא תלוי בשטח הפנים של האלקטרודות והסיבה לכך תובהר בהמשך.
כיצד נוצר כא”מ בתוך אלמנט גלווני?
אם האלמנט מספק זרם במשך זמן רב, אז עם הזמן, אלקטרודה אחת שלו (בדרך כלל, זו שעשויה מאבץ) מתמוססת. לכן אפשר להניח שיש קשר בין היווצרות הכא”מ לבין תהליך ההתמוססות של מתכת (קורוזיה גלוונית). ואכן, מניסויים מסתבר כי מתכת השקועה בתוך חומצה מדוללת עוברת תהליך של התמוססות (היא “נאכלת” על ידי החומצה – האלקטרוליט). מה שמעניין בתהליך זה הוא שלחומצה עוברים יונים חיוביים ולא אטומים ניטרליים של המתכת. האלקטרונים נשארים במתכת ולכן היא נטענת שלילית (תגובה כימית זו נקראת חמצון).
התהליך הזה נפסק מהר מאוד, מכיוון שככל שגדל ריכוז היונים בתמיסה, כך גובר התהליך ההפוך: היונים המקיפים את האלקטרודה מתנגשים ו”נבלעים” בה כתוצאה מהתנועה התרמית שלהם, והאלקטרונים שבמתכת הופכים כל יון כזה לניטרלי. במהרה נוצר מצב של שיווי משקל: מספר היונים שעוברים לתמיסה בפרק זמן מסוים, שווה למספר היונים ששוקעים על המתכת באותו פרק הזמן (השקעה – deposition זה תהליך הפוך להמסה – dissolution). למצב שיווי המשקל הזה מתאים הפרש פוטנציאלים מסוים בין המתכת לבין התמיסה, שתלוי בסוג המתכת והתמיסה. כמובן שהפרש הפוטנציאלים הזה לא תלוי במימדים של האלקטרודה, מפני שמצב שיווי המשקל מתקיים בכל חלקי האלקטרודה שבאים במגע עם האלקטרוליט.
יש לציין כי כמעט כל מתכת שנטביל באלקטרוליט תהפוך להיות טעונה שלילית. באלמנט וולטה למשל, גם האבץ וגם הנחושת מאבדים יונים חיוביים שעוברים לתמיסה ולכן שתי האלקטרודות הופכות להיות טעונות שלילית. אולם ריכוז המטען השלילי ולכן גם הפרש הפוטנציאלים בין החומצה לבין הנחושת קטן יותר מהפרש הפוטנציאלים שבין החומצה לאבץ. כלומר, על מנת לעשות שימוש במתח שבין החומצה למתכת צריך שבתוך החומצה תהיה אלקטרודה נוספת מחומר אחר. הרי אם נכניס לתוך חומצה גופרתית שתי אלקטרודות אבץ, הפרש הפוטנציאלים בין כל אלקטרודה לבין החומצה יהיה זהה, ולכן המתח בין האלקטרודות עצמן יהיה שווה לאפס, ולא נוכל להשתמש בתא כזה במעגל. אולם אם האלקטרודה השנייה תהיה עשויה מחומר שונה, הפרש הפוטנציאלים בינה לבין התמיסה יהיה שונה מהפרש הפוטנציאלים שבין האלקטרודה הראשונה לבין התמיסה. מכאן שיהיה מתח מסוים בין האלקטרודות והוא יהיה תלוי בחומרים שמהם עשויות התמיסה והאלקטרודות.
לדוגמה, באלמנט וולטה (אבץ – חומצה גופרתית – נחושת), הפרש הפוטנציאלים בין החומצה לאבץ, וגם בין החומצה לנחושת, הינו שלילי. במילים אחרות, אם נמדוד פוטנציאלים ביחס לחומצה (שאת הפוטנציאל שלה נקבע כאפס), נקבל כי פוטנציאל הנחושת הוא $-U_1$ ופוטנציאל האבץ הוא $-U_2$. כמו כן, נגלה כי $(-U_1)-(-U_2)=U_2 – U_1 = 1.1 \mathrm{V}$. המתח הזה יגרום לאלקטרונים לעבור (דרך התיל) מאלקטרודת אבץ, היכן שעודף האלקטרונים גדול יותר, לאלקטרודת נחושת, היכן שהעודף קטן יותר (הכיוון המוסכם של הזרם הינו הפוך: מ-$\mathrm{Cu(+)}$ ל-$\mathrm{Zn(-)}$). כעת אנו גם מבינים מדוע הכא”מ לא תלוי במימדי האלקטרודות: המתח שבין האלקטרוליט לאלקטרודות תלוי אך ורק בחומרים שמהם הם עשויים ולא בפרמטרים אחרים.
בחזרה לתא דנאיל – נראה כיצד נעים מטענים במעגל חשמלי סגור ואיך האלמנט הזה שומר על זרם חשמלי קבוע. באיור 3 יש תיאור סכמטי של מעגל חשמלי בו תא דניאל משמש כמקור מתח (שימו לב כי המבנה של תא דניאל נראה קצת שונה, אך מבחינה עקרונית, הוא שקול למה שהצגנו למעלה). מימין למחיצה נמצאת אלקטרודת אבץ בתוך תמיסה של אבץ גופרתי ($\mathrm{ZnSO_4}$), ומשמאלה – אלקטרודת נחושת בתוך תמיסה של נחושת גופרתית ($\mathrm{CuSO_4}$). כאשר תא דניאל לא מחובר למעגל, בין קטביו שורר מתח חשמלי המתאים למצב של שיווי משקל, כלומר למצב בו כמות היונים שעוזבים אלקטרודה שווה לכמות היונים שחוזרים אליה. המתכות לא מתמוססת ולא שוקעות; ריכוז התמיסות לא משתנה.
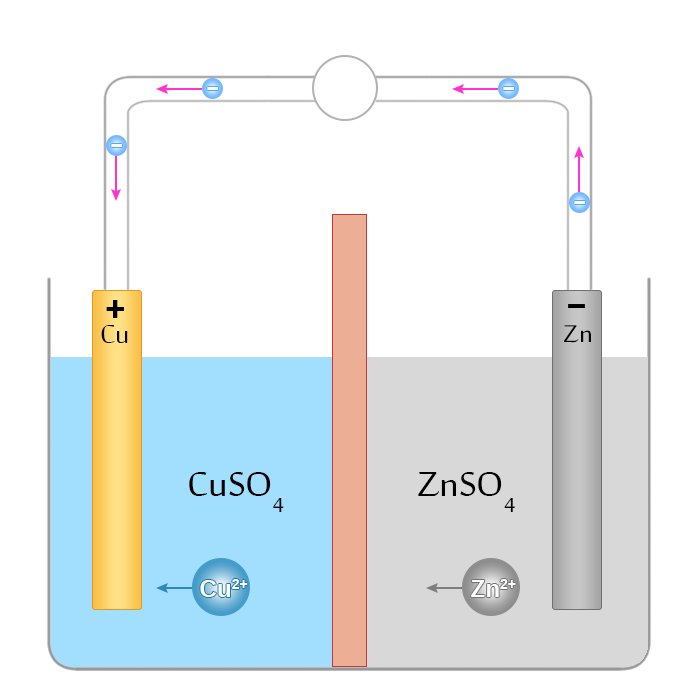
איור 3 – תיאור סכמנטי של תנועת מטענים בתוך תא דניאל המרכיב מעגל סגור.
כאשר נחבר את האלקטרודות לתיל מתכתי, כמתואר באיור, האלקטרונים יעזבו את האלקטרודה בעלת הפוטנציאל הנמוך (אבץ) ויעברו לאלקטרודה בעלת הפוטנציאל הגבוה (נחושת). כמו כן, יופר מצב שיווי המשקל בין האלקטרודה לאלקטרוליט בשני חלקי התא. אלקטרודת האבץ לא תהיה טעונה שלילית במידה מספקת (מכיוון שחלק מהאלקטרונים יעזבו אותה), בעוד שאלקטרודת הנחושת תהפוך ליותר מדי שלילית (יגיעו אליה אלקטרונים “מיותרים”). כתוצאה מכך, האבץ יתחיל להתמוסס – יותר יוני $\mathrm{Zn^{2+}}$ יעברו אל האלקטרוליט, בעוד שהאלקטרונים יישארו על האלקטרודה ובכך “יפצו” על המטען השלילי שעזב אותה. בחלק השמאלי של התא יקרה התהליך ההפוך: יותר יוני $\mathrm{Cu^{2+}}$ יהפכו להיות ניטרלים הודות לאלקטרונים העודפים, וישקעו על האלקטרודה. בגלל התמוססות האבץ ושקיעת הנחושת ייווצר מתח קבוע בין האלקטרודות ולכן במעגל ייווצר זרם קבוע.
היינו מצפים שבחלק הימני של התא יצטברו יוני $\mathrm{Zn^{2+}}$ עודפים ובחלק השמאלי – יוני $\mathrm{SO^{2-}_{4}}$ עודפים. אבל היונים הללו, שהם שוני סימן מבחינת המטען החשמלי, יימשכו זה לזה. מפני שהמחיצה נקבובית, יוני $\mathrm{SO^{2-}_{4}}$ יעברו דרכה לחלק הימני של התא והריכוז של $\mathrm{ZnSO_{4}}$ שם יגדל. בחלק השמאלי יקרה הדבר ההפוך – בגלל עזיבת יוני $\mathrm{Cu^{2+}}$ לנחושת ועזיבת יוני $\mathrm{SO^{2-}_{4}}$ לחלק הימני, ריכוזה של $\mathrm{CuSO_4}$ יקטן.
ברור כי התא לא יכול לפעול כך במשך זמן לא מוגבל. עם הזמן, הריכוז של $\mathrm{ZnSO_{4}}$ יגיע לנקודת הרוויה ובתמיסה יתחילו לשקוע גבישי $\mathrm{ZnSO_{4}}$. בנוסף, בחלק השמאלי הריכוז של $\mathrm{CuSO_4}$ יהיה כה נמוך שהכא”מ של האלמנט ירד לאפס. לכן, בכדי להאריך את זמן החיים של תא דניאל, מוסיפים לתמיסה גבישי $\mathrm{CuSO_{4}}$ אשר בהדרגה מתמוססים ושומרים על מצב הרוויה של התמיסה. בתוך הכלי, הגבישים העודפים $\mathrm{CuSO_{4}}$ ו-$\mathrm{ZnSO_{4}}$ נמצאים על הקרקעית (הם אינם מוצגים באיור).
אם כן, בזמן שבחלק החיצוני של המעגל (בתיל), האלקטרונים נעים מהפוטנציאל הנמוך לגבוה, כלומר מאלקטרודת האבץ לאלקטרודת הנחושת, בתוך האלקטרוליט נעים יונים שליליים (אניוני $\mathrm{SO^{2-}_{4}}$) מנחושת לאבץ, ויונים חיוביים (קטיוני $\mathrm{Cu^{2+}}$ ו-$\mathrm{Zn^{2+}}$) מאבץ לנחושת. כלומר גם בתא דניאל וגם במעגל החיצוני קיימת תנועה של מטענים. הכיוונים שבהם נעים האלקטרונים והקטיונים מסומנים באיור 3 באמצעות חצים. למרות שלא כל המטענים נעים בכיוון אחד, נוצר זרם שקול שכיוונו מנחושת לאבץ (כאמור, לפי המוסכמה, כיוון הזרם הוא מהפוטנציאל הגבוה לנמוך).
חישוב הכא”מ של מקור מתח
האנרגיה המשתחררת בתהליכים כימיים כמו אלו שתיארנו קודם היא בדיוק האנרגיה שמסופקת למעגל החיצוני. בתא דניאל, כפי שראינו, יש שני תהליכים כאלה: התמוססות האבץ והפיכתו ל-$\mathrm{ZnSO_{4}}$ מחד גיסא, ושקיעה של נחושת מתוך $\mathrm{CuSO_{4}}$ מאידך גיסא. בתהליך הראשון משתחררת אנרגיה. באמצעות קלורימטר אפשר להיווכח כי לכל מול של אבץ נפלטת אנרגיה של $4.4 \cdot 10^5 \mathrm{J}$ (בצורת חום). מנגד, תהליך שקיעת הנחושת מצריך אנרגיה. לשחרור מול אחד של נחושת נדרשת אנרגיה של כ-$2.34 \cdot 10^5 \mathrm{J}$. ההפרש בין האנרגיות נותן לנו את האנרגיה שמספק מקור המתח לכל מול. ($(4.4 – 2.34) \cdot 10^5 \mathrm{J} = 2.06 \cdot 10^5 \mathrm{J}$).
מכאן פשוט למצוא את גודל הכא”מ של תא דניאל. נניח כי המתח $U$ בין האלקטרודות שווה בקירוב לכא”מ של התא. אזי העבודה שמבצע מקור המתח על מטען $q$ שעובר במעגל היא $q U$. אבל לכל מול של נחושת (דו-ערכית) שמשתחררת על האלקטרודה, דרך המעגל עובר מטען $q=2 \cdot 96,484 \mathrm{C}$. לכן העבודה שמתבצעת על המטען שווה ל-$2 \cdot 96,484 \cdot U \approx 1.93 \cdot 10^5 U$. כמובן שהעבודה הזאת צריכה להיות שווה לאנרגיה שמספק התא. כלומר:
\[1.93 \cdot 10^5 \cdot U = 2.06 \cdot 10^5\]ולכן
\[U=1.07 \mathrm{V}\]ערך זה מאוד קרוב לערך הכא”מ האמיתי של תא דניאל ($1.09 \mathrm{V}$).
מובן כי התמוססות אלקטרודת האבץ מתרחשת רק כאשר התא מחובר למעגל חשמלי וזורם בו זרם. כאשר התא אינו פעיל, האלקטרודה לא אמורה להתמוסס. אולם בפועל, כן תתרחש התמוססות. הסיבה לכך היא שבדרך כלל, האלקטרודה לא עשויה מאבץ טהור ויש בה גם מתכות אחרות שבאות במגע עם האלקטרוליט והן בעצמן הופכות למין אלקטרודה. בצורה כזאת, אבץ “מזוהם” הטבול בתוך חומצה, פועל בעצמו כמו אלמנט גלווני (והוא אכן “פועל” כי הוא נמצא בתוך סביבה מוליכה ולכן אפקטיבית, יש פה מעגל חשמלי סגור). כתוצאה מהזרם החשמלי הלא רצוי הזה האלקטרודה מתמוססת גם כאשר התא לא מחובר למעגל סגור. בכדי למנוע זאת, משתמשים במתכות טהורות.